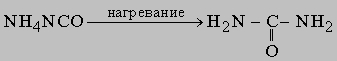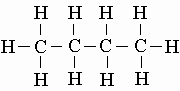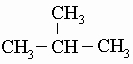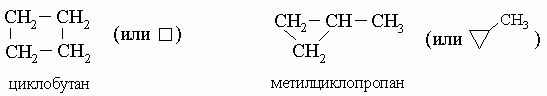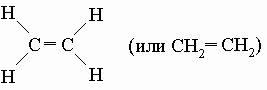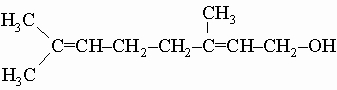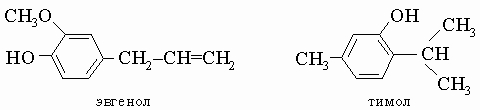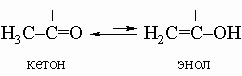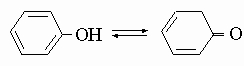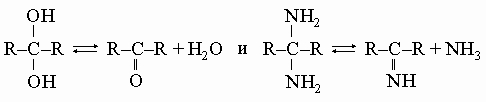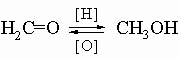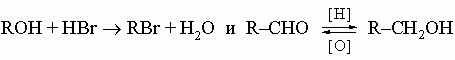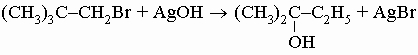Органические соединения (углеводороды и их производные) можно разделить на два типа: ациклические (или алифатические, т.е. с открытой углеродной цепью) и циклические; последние в свою очередь подразделяются на алициклические, в молекулах которых содержатся углеродные кольца неароматического характера; ароматические, проявляющие свойства, характерные для бензола; гетероциклические, в которых один или несколько атомов в кольце представляют собой атомы неметаллов, отличные от углерода. Внутри каждого из этих типов возможна дальнейшая дифференциация на классы по присутствующим в них реакционным центрам - функциональным группам. Например, органические соединения, имеющие карбоксильную группу -СООН, являются кислотами и вступают в реакции, характерные для кислот (нейтрализация оснований, образование эфиров со спиртами и т.д.). Реакции таких групп несколько изменяются при изменении структуры молекулы, в которой они находятся; на них могут влиять и другие группы в молекуле, хотя это влияние обычно мало. Ниже перечислены типичные функциональные группы с примерами наиболее значимых и интересных представителей каждого класса, затем рассматриваются реакции функциональных групп (разд. IV. "Реакции органических соединений").
А. УГЛЕВОДОРОДЫ
Углеводороды являются соединениями углерода и водорода. (Простейший углеводород - метан СН4.) Алифатические и алициклические углеводороды могут содержать прямые (неразветвленные), разветвленные или замкнутые в кольца цепи углеродных атомов. Если четыре углеродных атома соединены один с другим только простыми (одинарными) связями, образуется углеводород бутан C4H10 с открытой (неразветвленной) цепью:
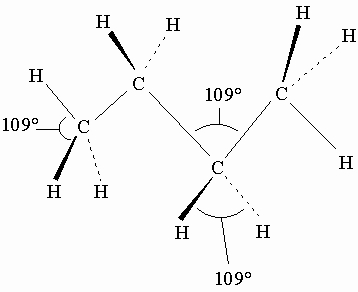
Здесь черточки изображают ковалентные связи между углеродными атомами в плоскости страницы, пунктирные линии - связи с атомами водорода ниже, а жирные клинообразные линии - с атомами водорода выше этой плоскости. Углы между углерод-углеродными связями 109°. Эта молекула может свободно вращаться вокруг простых связей (что вообще справедливо для простых связей). Структурную формулу бутана можно написать как
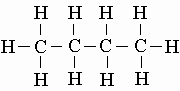
либо проще, CH3-CH2-CH2-CH3 или CH3CH2CH2CH3. Для четырех углеродных атомов, связанных простыми связями, возможна также структура с разветвленной цепью:
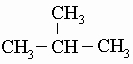
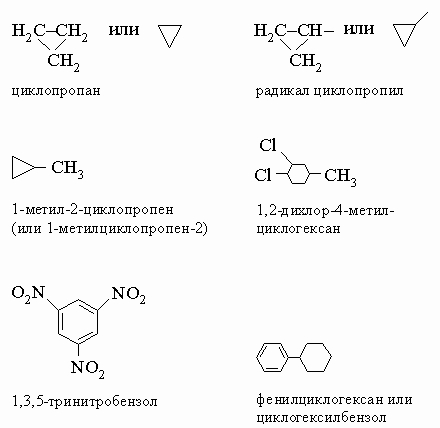
Эта формула изображает другое соединение - изобутан, у которого иные свойства, чем у бутана (например, более низкие температуры кипения и замерзания). Заметим, что и бутан, и изобутан имеют один и тот же состав: C4H10. Такие соединения, с одинаковыми брутто-формулами, называются "изомерами". Изомерия - обычное явление в органической химии, для сложных формул возможны миллиарды изомеров. Существуют два циклических четырехуглеродных (C4) углеводорода, содержащих только простые связи: циклобутан и метилциклопропан, оба имеют брутто-формулу C4H8:
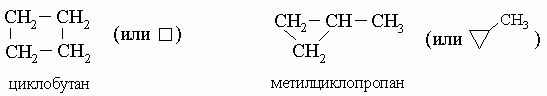
Насыщенные и ненасыщенные углеводороды. Насыщенные (предельные) углеводороды - алканы (парафины) - содержат только простые (одинарные) связи между атомами углерода (например, метан, бутан, изобутан и циклобутан). Если в молекуле присутствует кратная (двойная, тройная) связь, соединение называют ненасыщенным (или непредельным) - это алкены (олефины) и алкины (ацетилены). Алканы обычно химически инертны, поскольку все валентные электроны углерода и водорода прочно связаны в сильных ковалентных связях. Метан, бутан и изобутан представляют собой алканы. Циклоалканы, представителями которых являются циклобутан и метилциклопропан, - алканы, содержащие кольцо из углеродных атомов. У ненасыщенных углеводородов реакционный центр находится по месту кратной связи. Они вступают в разнообразные химические реакции гораздо легче, чем насыщенные углеводороды. Простейший из алкенов - этилен:
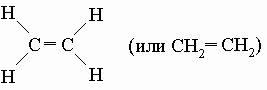
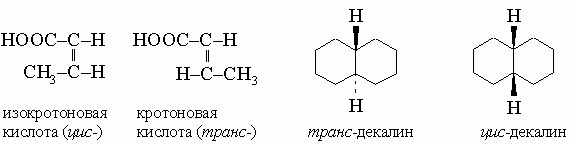
Все атомы этой молекулы лежат в одной плоскости. Вращение вокруг двойных связей невозможно, поэтому если два олефина одинакового состава различаются расположением групп относительно двойной связи, то они не идентичны и называются цис-транс-изомерами. У цис-изомеров одинаковые группы, соседние с двойной связью, расположены по одну сторону двойной связи, тогда как в транс-изомерах - по разные стороны.
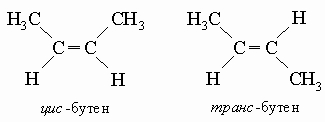
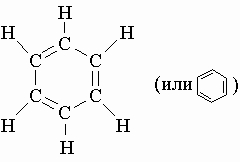
Ацетилен H-CєC-H является простейшим алкином. Все его атомы лежат на прямой линии, поэтому цис-транс-изомерия невозможна, хотя атомы, связанные тройной связью, не могут вращаться друг относительно друга. Молекула бутина-2 H3C-CєC-CH3 также линейна. Ароматические углеводороды содержат шестичленные кольца условно с тремя двойными связями, чередующимися с тремя простыми. Простейшим соединением этого типа является бензол, имеющий структуру
Свойства. Углеводороды представляют собой наименее полярные из органических молекул, поскольку связи C-H почти полностью ковалентны. В результате они имеют относительно низкие температуры кипения (т. кип.) и плавления (т. пл.) по сравнению с другими органическими соединениями. Углеводороды, содержащие в цепи до четырех атомов углерода включительно, при атмосферном давлении и комнатной температуре газообразны; к ним относятся топливные газы метан CH4, этан C2H6, пропан C3H8 и бутан C4H10 (последние два обычно продают в баллонах под давлением). Насыщенные неразветвленные углеводороды становятся твердыми при комнатной температуре, начиная с углеводорода C16. Разветвленные и ненасыщенные углеводороды являются более низкоплавкими соединениями; например, углеводород с прямой цепью гексадекан CH3(CH2)14CH3, или C16H34, плавится при 20° С, а разветвленный углеводород тетрамер 2-метилпропена (C4H8)4, или C16H32, затвердевает при -139° С, тогда как ненасыщенный углеводород гексадецин-2 CH3(CH2)12CєCCH3, или C16H30, имеет т. пл. -25° С. Циклическим соединениям свойственны более высокие температуры плавления, чем алифатическим (с открытой углеродной цепью) соединениям той же молекулярной массы; например, у 1,3-диметилциклогексана C6H10(CH3)2 т. пл. -85° С, т.е. на 19° С выше, чем у неразветвленного углеводорода октена C8H16, который имеет ту же брутто-формулу (и поэтому ту же молекулярную массу), но плавится при -104° С. Все углеводороды горят, образуя углекислый газ и воду. Химические реакции насыщенных, ненасыщенных и ароматических соединений совершенно отличны друг от друга.
Практически важные углеводороды. Ниже перечислены некоторые имеющие большое практическое значение углеводороды, их свойства и применения. Метан CH4 - бесцветный, не имеющий запаха газ с т. кип. -162° С. Он является главным компонентом природного газа, широко используемого как топливо. Сырая нефть - сложная смесь углеводородов (и некоторых следовых соединений) вплоть до С40. Перегонка и химическая переработка нефти дают множество промышленных углеводородов и очищенных смесей углеводородов. К продуктам, получаемым перегонкой нефти, относятся (в порядке повышения т. кип.) разбавители для красок, бензин, керосин, минеральные масла, смазочные масла и асфальт
(см. НЕФТЕХИМИЧЕСКИЕ ПРОДУКТЫ;
ХИМИЯ И МЕТОДЫ ПЕРЕРАБОТКИ НЕФТИ). Циклопропан - бесцветный горючий газ с т. кип. -33° С. Его используют в органическом синтезе и медицине (как анестетик). Этилен H2C=CH2, бесцветный газ с т. кип. -102° С. Исходный материал для синтеза ряда химических продуктов, в том числе этилового спирта и полиэтилена (см. ПЛАСТМАССЫ). Пропилен H3C-CH=CH2, бесцветный газ с т. кип. -48° С. Мономер полипропилена.
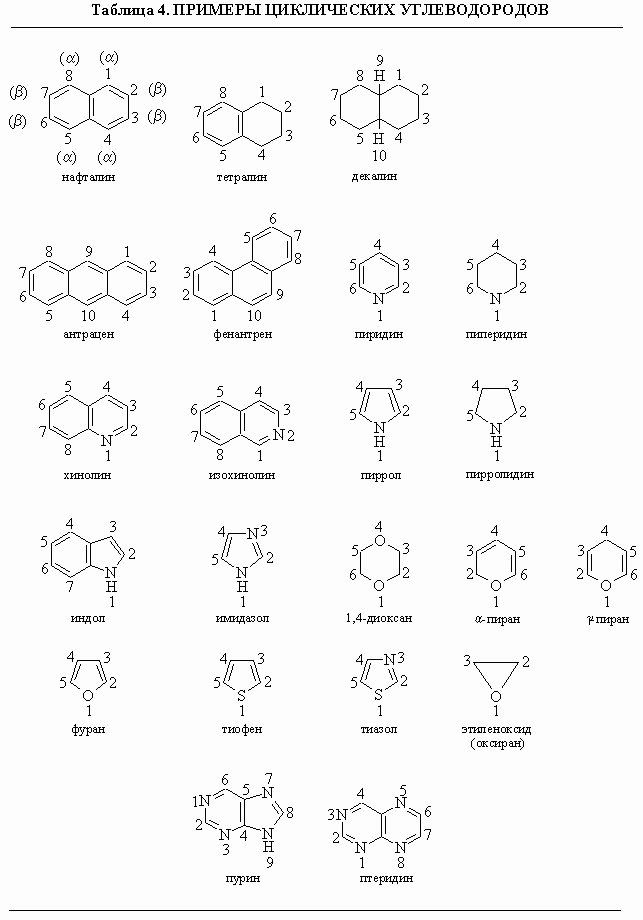
Бутадиен и стирол. Бутадиен H2C=CH-CH=CH2, бесцветный горючий газ без запаха с т. кип. -4,5° С. Стирол C6H5CH=CH2, бесцветная жидкость со специфическим запахом ароматических соединений, т. кип. 146° С. Эти углеводороды служат исходными мономерами для получения ряда пластмасс и каучуков. Бензол C6H6, прозрачная, бесцветная, горючая жидкость с характерным запахом, т. кип. 80° С. Бензол широко используется как растворитель и исходный материал для синтеза многих органических соединений, включая взрывчатые вещества, красители и медицинские препараты. Нафталин C10H8 с молекулярной структурой в виде двух конденсированных колец (см. табл. 4). Это белые кристаллические пластинки с т. пл. 80° С, вещество летуче. Общеизвестно его применение в виде шариков для отпугивания моли; сырье в производстве красителей. Ацетилен HCєCH, бесцветный газ с т. кип. -83° С. Его применяют как горючее в ацетиленовых горелках для резки и сварки металлов, а также для синтеза многих других органических соединений.
Б. ОРГАНИЧЕСКИЕ ГАЛОГЕНИДЫ
Органические галогениды имеют общую формулу R-X, где R - стандартное обозначение для углеводородных групп, а X - атом галогена (фтора, хлора, брома или иода). Органические галогениды очень важны как исходные реагенты органического синтеза и растворители. Так же, как и углеводороды, они не очень полярны, и многие из них являются жидкостями. Некоторые из них ядовиты (например, тетрахлорид углерода), другие совершенно нетоксичны (например, фреоны, используемые в холодильниках для хранения пищевых продуктов). Хлориды гораздо дешевле бромидов и иодидов и потому находят более широкое применение в качестве растворителей. Практически важные органические галогениды. Тетрахлорид углерода CCl4, бесцветная негорючая жидкость, т. кип. 77° С. Его широко используют в качестве растворителя жиров и для выведения пятен, но он довольно ядовит и вдыхание заметных количеств его паров вызывает серьезное повреждение печени. Раньше его применяли для пожаротушения, но от этого пришлось отказаться, так как при высоких температурах из него может образоваться смертельно опасный газ фосген COCl2. Хлороформ (трихлорметан) CHCl3, жидкость со сладковатым запахом, т. кип. 61° С. Его широко применяли как анестетик, но поскольку он ядовит, были разработаны заменяющие его анестезирующие средства. Однако его еще используют для гуманного умерщвления животных. Как и тетрахлорид углерода, хлороформ является прекрасным растворителем. Трихлорэтилен ClCH=CCl2, стабильная, тяжелая, ядовитая жидкость, т. кип. 87° С. Широко применяется как растворитель для химической чистки наряду с другими сходными хлорсодержащими растворителями; все они дешевы, не слишком летучи и менее токсичны, чем тетрахлорид углерода. Дихлордифторметан CCl2F2, бесцветный инертный газ без запаха, т. кип. -30° С. Один из низкомолекулярных хлорфторуглеводородов, называемых фреонами или хладонами, которые использовались как хладагенты и пропелленты в аэрозолях для распыления красок, инсектицидов и т.д. К фреонам относятся также хлордифторметан и хлортрифторметан. Все фреоны нетоксичны и не вызывают коррозии, но в настоящее время международные экологические соглашения предусматривают постепенную замену их другими соединениями с аналогичными физическими свойствами, поскольку фреоны, попадая в стратосферу, способствуют разрушению защитного озонового слоя Земли. См. также ХОЛОДИЛЬНАЯ ТЕХНИКА. Тетрафторэтилен F2C=CF2, бесцветный газ с т. кип. -78,4° С, который полимеризуется, образуя тефлон, химически инертный полимер со структурой F(CF2)nF. Хлоропрен H2C=CCl-CH=CH2, бесцветная жидкость, т. кип. 59,4° С. Его используют преимущественно для производства хлоропренового (неопренового) каучука.
См. также КАУЧУК И РЕЗИНА. Винилхлорид H2C=CHCl, легко ожижаемый газ, т. кип. -13,9° С. Его применяют как хладагент и в производстве пластмасс. Метилбромид (бромметан) CH3Br, ядовитый газ, т. кип. 5° С. Используется для стерилизации почвы, так как в высоких концентрациях убивает все живые организмы; он безвреден для человека в низких концентрациях при кратковременном контакте.
В. СПИРТЫ
Спирты имеют общую структурную формулу ROH. Группа -OH высокополярна, и поэтому спирты гораздо более растворимы в воде и других полярных растворителях, чем углеводороды, галогениды или простые эфиры. Простые спирты, содержащие менее четырех атомов углерода, смешиваются с водой во всех соотношениях. Благодаря полярному характеру спиртов, их точки кипения также относительно высоки. Так, пропан C3H8, метилхлорид CH3Cl и этиловый спирт C2H5OH имеют приблизительно одинаковые молекулярные массы, но их т. кип. лежат соответственно при -24° С, -42° С и +78° С. Первые два соединения почти полностью нерастворимы в воде, тогда как этиловый спирт смешивается с ней в любых пропорциях. Спирты вступают в многочисленные и разнообразные реакции и поэтому имеют большое значение в качестве промежуточных соединений в синтезах. Они также являются важными промышленными растворителями.
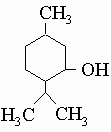
Практически важные спирты. Метиловый спирт (метанол) CH3OH, бесцветная растворимая в воде жидкость, т. кип. 65° С. Когда-то его получали сухой перегонкой дерева и потому его иногда называют "древесный спирт". Теперь его производят в наибольших количествах из нефти. Метиловый спирт - это смертельный яд, и его потребление внутрь может привести к слепоте или смерти. Он представляет собой важный растворитель для полярных соединений и используется в больших количествах как антифриз. Для последней цели его летучесть является серьезным недостатком, так как требует долива по мере испарения. Этиловый спирт (этанол) C2H5OH, бесцветная жидкость, т. кип. 78° С, полностью растворима в воде. Именно этиловый спирт содержится в спиртных напитках и приготавливается для этой цели сбраживанием крахмала, сахара или зерна. Он также находит широкое применение как промышленный растворитель и для приготовления настоек, которые являются просто растворами в спирте. Большие количества этилового спирта получают из этилена (продукта нефтяной промышленности). Этиловый спирт служит исходным материалом для приготовления длинного списка продуктов химической промышленности: уксусной кислоты, сложных эфиров и многих других низкомолекулярных соединений. Пищевой спирт идет на изготовление алкогольных напитков, но технический этиловый спирт выпускается также в виде т.н. денатурата, непригодного для питья, но подходящего для многих других целей. Денатурирование достигается прибавлением нескольких процентов постороннего трудно удаляемого вещества. Поступающий в продажу этиловый спирт содержит около пяти процентов воды, которую нельзя удалить простой перегонкой водно-спиртовой смеси. От последних следов воды можно избавиться перегонкой с небольшим количеством бензола или другими способами, дающими безводный "абсолютный" спирт. Изопропиловый спирт (изопропанол) (CH3)2CH-OH, бесцветная жидкость, т. кип. 82° С. Изопропиловый спирт используется как растворитель и как промежуточное вещество для получения сложных эфиров и других продуктов химической промышленности. Бутиловый спирт (бутанол) CH3CH2CH2CH2OH, бесцветная, частично растворимая в воде жидкость, т. кип. 118° С. В промышленности его получают сбраживанием крахмала (зерна) или сахаров при помощи особого штамма микроорганизмов, которые продуцируют бутиловый спирт и ацетон, а не этиловый спирт. н-Бутанол (нормальный бутиловый спирт, т.е. с неразветвленной углеродной цепью) находит широкое применение в производстве растворителей для лаков. Сивушное масло является смесью C5-спиртов, образующихся в качестве побочного продукта при получении других спиртов посредством брожения. Более обычный способ получения C5-спиртов, используемых в качестве растворителей и для приготовления эфиров, состоит в гидролизе C5-хлоридов, продуктов хлорирования соответствующей нефтяной фракции. Этиленгликоль HOCH2CH2OH, прозрачная, бесцветная, сиропообразная жидкость, т. кип. 198° С. Этиленгликоль находит широкое применение как антифриз, поскольку он полностью растворим в воде, дешев, нелетуч и сильно снижает точку замерзания водных растворов (60%-ный раствор этиленгликоля в воде замерзает при -40° С). Этиленгликоль умеренно ядовит. Глицерин HOCH2CH(OH)CH2OH, прозрачная, сладкая на вкус, бесцветная или желтоватая сиропообразная жидкость, полностью растворимая в воде, т. кип. 290° С. Легко перевариваемый и нетоксичный, глицерин находит применение как увлажняющий и текстурирующий агент в пищевых продуктах, в косметике (кремы для рук) и некоторых медицинских препаратах. В связанном виде глицерин присутствует во всех жирах и получается в больших количествах как побочный продукт при производстве мыла. Однако этого источника недостаточно для полного удовлетворения спроса на глицерин, и потому его синтезируют из продуктов переработки нефти. Одно из его главных промышленных применений - получение взрывчатого вещества нитроглицерина O2NOCH2CH(ONO2)CH2ONO2 при обработке азотной кислотой. Динамит является смесью нитроглицерина с наполнителем (см. также ГЛИЦЕРИН). Ментол, относительно летучее твердое вещество, т. пл. 43° С, является главным компонентом масла перечной мяты. Он обладает приятным запахом, и в малых количествах, будучи примешан к сигаретному дыму, каплям от кашля, жевательной резинке и другим продуктам, вызывает ощущение "холода" во рту. Его структурная формула
Гераниол C10H17OH и цитронеллол C10H19OH являются главными компонентами розового масла, которому они придают приятный запах. Они используются для приготовления духов. Существуют два изомера гераниола, отличающихся только положением наиболее удаленной от ОН-группы двойной связи. Один из этих изомеров изображается формулой
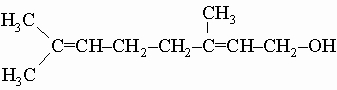
Цитронеллол отличается только отсутствием ближайшей к ОН двойной связи. Стерины (стеролы) - общее название твердых кристаллических спиртов стероидного ряда (см. также СТЕРОИДЫ), которые содержат ОН-группу при С-3 и алифатическую боковую цепь при С-17 в пергидроциклопентанофенантреновом скелете. Примерами стеринов являются холестерин, ситостерин и эргостерин. Стерины найдены как в растительных, так и животных тканях, где входят в состав клеточных липидных мембран. У животных холестерин служит исходным веществом для биосинтеза стероидных гормонов.
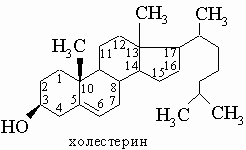
Г. ФЕНОЛЫ
Фенолы - это ароматические спирты общей формулы R-OH, где группа R является остатком ароматического углеводорода (т.е. бензола, нафталина или родственного им циклического соединения). Фенолы - слабые кислоты. Практически важные фенолы. Фенол (карбоновая кислота), кристаллическое вещество, т. пл. 42° С. Обычно фенол используют в водном растворе, причем небольшое количество воды служит для "разжижения" большого количества фенола. Он имеет сильный характерный запах и представляет собой эффективный антисептик. Во время Первой мировой войны фенол широко использовался в виде разбавленного раствора для обеззараживания ран, но в современной практике его вытеснили более действенные и менее едкие дезинфицирующие средства.
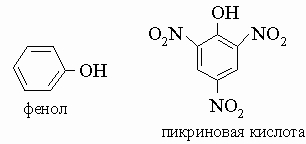
Среди промышленных продуктов, производимых из фенола, заслуживает упоминания пикриновая кислота - желтое красящее и взрывчатое вещество, применявшееся в больших количествах в Первой мировой войне, и различные другие красители. Креозот, используемый для предохранения и защиты древесины, содержит фенол и другие соединения, которые задерживают рост бактерий и отпугивают насекомых. Метилфенолы (крезолы) являются наиболее значимыми среди других фенольных соединений; их применяют в производстве феноло-формальдегидных смол, дезинфицирующих средств, фунгицидов, гербицидов, азокрасителей и т.д.
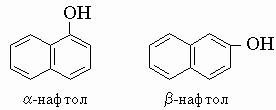
Нафтолы. a-Нафтол, бесцветное или желтоватое твердое вещество с неприятным запахом, применяется в производстве красителей и синтетических душистых соединений, т. кип. 278° С. b-Нафтол, имеющий ту же брутто-формулу C10H7OH, белое блестящее твердое вещество, т. кип. 285° С; его используют как дезинфектант и в производстве красителей, медикаментов и синтетических душистых соединений.
Гидрохинон (1,4-дигидроксибензол) C6H4(OH)2, водорастворимое твердое вещество, т. кип. 285° С. Его применяют как фотографический проявитель для восстановления активированных солей серебра в черное мелкодисперсное металлическое серебро.
Эвгенол и тимол. Эвгенол, бесцветная или желтоватая маслянистая жидкость, т. кип. 254° С; тимол, белое кристаллическое вещество с "ароматическим" запахом, т. кип. 233° С, и некоторые другие родственные фенолы широко распространены в эфирных маслах, например, масле гвоздики (эвгенол) и тимьяна.
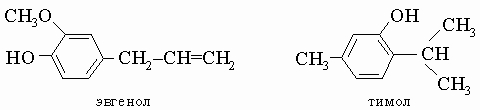
Ванилин, белое кристаллическое вещество, т. кип. 285° С; слегка растворим в воде. Он является основным душистым компонентом ванили. По этой причине его широко применяют в искусственных отдушках, причем лишь небольшой концентрации достаточно, чтобы обеспечить сильный ванильный запах. Для его синтеза имеется несколько путей.
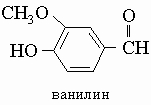
Заметим, что ванилин содержит наравне с фенольной простую эфирную и альдегидную группы.
Д. КАРБОНОВЫЕ КИСЛОТЫ
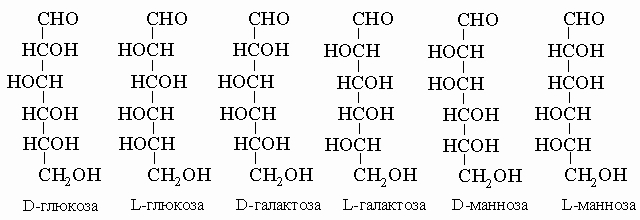
Карбоновые кислоты имеют общую формулу R-COOH. Они являются кислотами средней силы, будучи сильнее, чем фенолы, но слабее, чем такие минеральные кислоты, как соляная, азотная или серная; как все кислоты, они имеют характерный кислый вкус. Поскольку эти кислоты высокополярны, они кипят при температурах даже более высоких, чем спирты, а простейшие кислоты (содержащие до пяти атомов углерода в цепи) растворимы в воде. Низшие кислоты - жидкие вещества, но с увеличением длины углеродной цепи повышаются и температуры плавления. Карбоновые кислоты вступают во многие важные химические реакции, а получаемые из них разнообразные продукты находят широкое применение. Многие кислоты, содержащие С=О, -OH или несколько групп -COOH, играют существенную роль в биологическом обмене веществ (см. БИОХИМИЯ). Когда кислоты реагируют с основаниями, образуются ионные соли общей формулы RCOOM, где M - ион металла. Соли жирных кислот (алифатических карбоновых кислот с длинной цепью) называются мылами. Практически важные карбоновые кислоты. Муравьиная кислота HCOOH, простейшая из карбоновых кислот. Это водорастворимая жидкость, т. кип. 100,8° С. У многих жалящих насекомых муравьиная кислота служит раздражающим компонентом яда. Уксусная кислота CH3COOH, бесцветная прозрачная жидкость, т. кип. 118° С, важный промышленный продукт, получаемый путем сбраживания сахаров (или этилового спирта) или синтетически из нефтепродуктов либо ацетилена. Уксус представляет собой разбавленный раствор уксусной кислоты, получаемой брожением, причем его кислый вкус - это вкус уксусной кислоты. Она используется в производстве ряда пластмасс, волокон, синтетических покрытий и является хорошим растворителем. Масляная кислота CH3CH2CH2COOH, т. кип. 163° С, жидкость с отвратительным запахом, обусловливающая в значительной степени неприятный запах прогорклого масла. Она находит некоторое промышленное применение как растворитель и при приготовлении бутиратов. Стеариновая кислота CH3(CH2)16COOH, воскообразное вещество, т. пл. 70° С. Она широко распространена в связанной форме как компонент жиров и используется вместе с парафином в производстве свечей для улучшения их горючих свойств, в приготовлении натриевой соли для производства мыла и кальциевой соли для детских присыпок, в производстве резины, смазок и для многих других целей. Жирные кислоты - карбоновые кислоты алифатического ряда. Алифатические кислоты с числом углеродных атомов в молекуле больше 6 называют высшими жирными кислотами (ВЖК). ВЖК могут быть природными и синтетическими. Природные ВЖК - обычные одноосновные (содержат одну карбоксильную группу в молекуле), нормального строения (неразветвленные), могут быть насыщенными или ненасыщенными. Жирные кислоты с четным числом углеродных атомов, содержащие от двух до двадцати четырех атомов углерода, можно получить из природных жиров. Компонентами этих жиров являются многочисленные ненасыщенные кислоты, наиболее обычной среди которых является олеиновая CH3-(CH2)7-CH=CH-(CH2)7-COOH, содержащая подобно стеариновой 18 атомов углерода, но имеющая одну цис-углерод-углеродную двойную связь. Как и у других ненасыщенных кислот, ее точка плавления (16° С) значительно ниже, чем у соответствующих насыщенных кислот. Адипиновая кислота HOOC(CH2)4COOH, как все кислоты с двумя и более группами -COOH, представляет собой твердое вещество. Она используется в многотоннажном производстве найлона. Молочная кислота CH3CH(OH)COOH, легко растворимое в воде вещество, плавящееся при комнатной температуре (18° С) и имеющее большое значение в биологических системах. Это она придает кислый вкус прокисшему молоку. Лимонная кислота HOOC-C(OH)(CH2COOH)2, водорастворимое твердое вещество без запаха, содержится в плодах всех цитрусовых. Водный раствор кислоты очень похож по вкусу на сок лимона, и потому лимонная кислота используется в разнообразных напитках из-за ее характерного приятного кислого привкуса. Она играет существенную роль в превращениях сахаров в организме. Винная кислота HOOCCH(OH)CH(OH)COOH, существует в трех стереоизомерных формах, называемых D-, L- и мезо-. Она присутствует в винограде и может осаждаться в виде соли в винных бочках во время брожения. Эта соль, тартрат калия-натрия, обычно известна как винный камень.
Е. АЛЬДЕГИДЫ И КЕТОНЫ
Альдегиды и кетоны имеют общие формулы R-CH=O и R-CO-R соответственно. Карбонильная группа С=О высокореакционноспособна, и поэтому альдегиды и кетоны занимают необычайно важное место в органическом синтезе многочисленных и разнообразных соединений. Некоторые члены этого класса используются в качестве ароматических добавок и душистых веществ и частично обусловливают характерные запахи некоторых растительных экстрактов и эссенций.
Практически важные альдегиды и кетоны. Формальдегид CH2=O, газ, т. кип. -21° С, обычно используется в виде водного раствора под названием "формалин". Газообразный формальдегид полимеризуется в твердый параформ H(OCH2)nOH, из которого регенерируется при нагревании. Как и другие низкомолекулярные альдегиды, формальдегид имеет острый запах. Формалин используют для консервации биологических материалов, а формальдегид применяют в многотоннажных процессах производства синтетических волокон и пластмасс. Ацетон CH3COCH3, т. кип. 56° С, приятно пахнущая жидкость с высокой растворяющей способностью для таких материалов, как нитроцеллюлоза (используемая во взрывчатых веществах и лаках) и пластмассы. Ацетон применяется как растворитель и как разбавитель для лаков. Его также используют в синтезе более сложных органических соединений. Акролеин CH2=CH-CH=O, т. кип. 56° С; его пары обладают раздражающим действием на слизистую. Он образуется при пиролизе ("перегреве") жиров.
Бензохинон. Желтое легко возгоняющееся твердое вещество, бензохинон является простейшим членом класса соединений, известных как "хиноны", которые содержат подобную циклическую систему. Некоторые хиноны представляют собой важные красители, другие являются пигментами растений и насекомых.
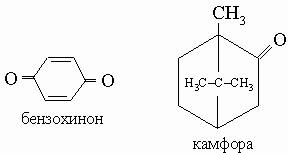
Камфора (камфара) представляет собой твердый летучий кетон с характерным приятным запахом. Из камфарного дерева получают L-форму, а D,L-форму производят в промышленных масштабах путем синтеза из других природных продуктов.
Ж. ПРОСТЫЕ ЭФИРЫ
Простые эфиры имеют общую структуру R-O-R', в которой R и R' представляют собой углеводородные группы. Низшие члены ряда являются жидкостями, полярность их молекул низка (как и в случае углеводородов и органических галогенидов).
Практически важные простые эфиры. Диэтиловый эфир C2H5OC2H5, обычно называемый просто "эфир", - прозрачная, бесцветная жидкость с характерным запахом, кипящая при 35° С. Эфир используют как анестетик для наркоза, как растворитель для различных органических веществ и для химической чистки одежды. Этиленоксид , т. кип. 11° С, высокореакционноспособный газ, применяемый в ряде органических синтезов, в том числе при получении этиленгликоля (первичный компонент большинства антифризов) и в производстве важного класса растворителей, известных под общим названием "целлозольвов" (R-O-CH2CH2-OH).
З. СЛОЖНЫЕ ЭФИРЫ
Сложные эфиры R-COOR' рассматриваются как производные карбоновых кислот, поскольку их можно получить отщеплением молекулы воды от кислоты и спирта: R-COOH + R'-OH -> R-COOR' + H2O Летучие эфиры - жидкости с приятным фруктовым ароматом, прекрасные растворители для органических веществ. Некоторые эфиры обусловливают аромат душистых растений.
Практически важные сложные эфиры. Этилацетат CH3COOC2H5, т. кип. 77° С, находит свое главное применение как растворитель. Он образуется в реакции между этиловым спиртом и уксусной кислотой в присутствии катализатора. Амилацетат CH3COOCH2CH2CH2CH2CH3, т. кип. 148° С, иногда называют "банановым маслом" (которое он напоминает по запаху). Он образуется в реакции между амиловым спиртом (часто - сивушным маслом) и уксусной кислотой в присутствии катализатора. Амилацетат широко применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.
Фруктовые эфиры. Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлен летучими эфирами, например этиловым и изоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот. Имеющиеся в продаже эссенции, имитирующие эти запахи, содержат подобные эфиры. Винилацетат CH2=CHOOCCH3, образуется при взаимодействии уксусной кислоты с ацетиленом в присутствии катализатора. Это важный мономер для приготовления поливинилацетатных смол, клеев и красок. Среди других сложных эфиров большое практическое значение имеют жиры, которые являются триэфирами глицерина и жирных кислот, а также воски - эфиры высокомолекулярных спиртов и высших жирных кислот.
И. АМИНЫ
Аминами называются производные аммиака NH3, получаемые путем замещения в нем атома H на органическую группу R; в зависимости от числа замещенных атомов водорода они могут быть первичными (RNH2), вторичными (R2NH) и третичными (R3N). (Присоединение четвертой группы R дает ряд ионных солей R4N+X-, напоминающих по структуре соли аммония, которые в противоположность аминам являются нелетучими твердыми веществами без запаха или с очень слабым запахом.) Амины представляют собой самую важную группу органических оснований: они имеют большое биологическое значение и применяются для получения разнообразных производных, включая красители и медицинские препараты.
Практически важные амины. Триметиламин (CH3)3N, подобно другим низкомолекулярным аминам, является газом с аммиачным, или "рыбным" запахом. Он образуется при разложении рыбы. Его получают взаимодействием метилового спирта или диметилового эфира с аммиаком; используют для производства бактерицидов, флотореагентов, кормовых добавок. Анилин C6H5NH2, т. кип. 184° С, бесцветная маслянистая жидкость, которая быстро становится бурой при контакте с воздухом и светом. Является исходным материалом для получения ряда анилиновых красителей, лекарственных средств (сульфамидных препаратов, ацетанилида и др.), взрывчатых веществ, анилино-формальдегидных смол, антиоксидантов, фотоматериалов и т.д. Адреналин, амфетамин (бензедрин) и эфедрин. Адреналин - гормон, выделяемый надпочечниками, который вызывает сужение капиллярных сосудов и тем способствует повышению давления крови. Секреция этого гормона увеличивается в моменты стресса, помогая организму адекватно реагировать на опасность. Амфетамин (бензедрин, синтетический препарат) и эфедрин имеют сходное действие.
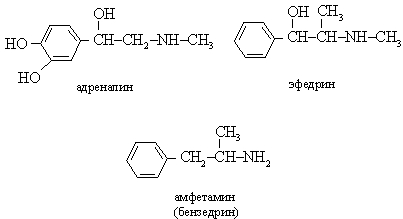
Аминокислоты содержат как амино-, так и кислотную карбоксильную группу. Аминокислоты играют большую роль в химии живых систем. Из них особенно важны a-аминокислоты общей структуры R-CH(NH2)-COOH, которые являются строительными блоками белков.
К. ДРУГИЕ ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
Азотсодержащие группы. Кроме аминов, азот содержат различные другие функциональные группы. Амиды имеют общую структуру RC(O)NR'R ", где R' и R " - органическая группа или H; почти все они являются твердыми веществами. Нитросоединения R-NO2 представляют собой важные промежуточные соединения в органическом синтезе и взрывчатые вещества - тринитротолуол, тринитрофенол (пикриновая кислота), нитроглицерин. В нитрилах азот связан с углеродом тройной связью R-CєN; азосоединения содержат группу -N=N-, которая придает окраску многим синтетическим красителям.
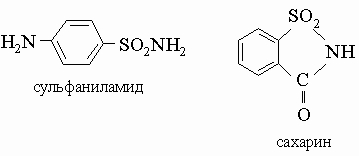
Соединения серы. Наиболее важными типами сернистых соединений являются меркаптаны (тиолы) R-SH и сульфокислоты R-SO3H, представляющие собой сильные кислоты. Низшие меркаптаны - газы или жидкости с неприятным запахом. Метилмеркаптан CH3SH - газ, используемый для придания легко распознаваемого неприятного запаха топливному газу, который сам по себе почти лишен запаха, с целью обнаружения утечек газа. Бутилмеркаптан CH3CH2CH2CH2SH - жидкость, обнаруженная в пахучих железах скунса. Соли сульфокислот с длинной углеводородной цепью используют как моющие средства; сульфаниламидные лекарственные препараты и сахарин - также производные сульфокислот.
Другая классификация. Чтобы подчеркнуть общий источник, функции или сложные структурные особенности, органические соединения часто классифицируют по другим признакам, чем их функциональные группы.
См. также
АЛКАЛОИДЫ;
БИОХИМИЯ;
ЦЕЛЛЮЛОЗА;
МОЮЩИЕ СРЕДСТВА;
КРАСИТЕЛИ И КРАШЕНИЕ;
ФЕРМЕНТЫ;
ЭФИРНЫЕ МАСЛА;
ЖИРЫ И МАСЛА;
ТОПЛИВО;
ГЛИКОЗИДЫ;
КРАСКИ И ПОКРЫТИЯ;
НЕФТЕХИМИЧЕСКИЕ ПРОДУКТЫ;
ПЛАСТМАССЫ;
БЕЛКИ;
КАУЧУК И РЕЗИНА;
КРЕМНИЙОРГАНИЧЕСКИЕ ПОЛИМЕРЫ;
МЫЛО;
ВИТАМИНЫ.